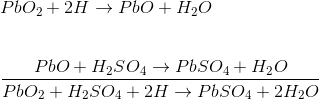مقالات, مقالات باتری و UPS
عملکرد باتری سربی اسیدی ثانویه
عملکرد باطری سربی اسیدی ثانویه | باطری ذخیره سازی سربی اسیدی ثانویه
عملکرد باطری سربی اسیدی در این مقاله مورد بحث قرارمیگیرد.
باطری ذخیره سازی یا باتری ثانویه از باتری هاییاست که در آن می توان انرژی الکتریکی را به عنوان انرژی شیمیایی ذخیرهکرد
و سپس این انرژی شیمیایی در هر زمانی که نیازباشد و در صورت نیاز به انرژی الکتریکیتبدیلمیشود. تبدیل انرژی الکتریکی به انرژی شیمیایی با استفاده از منبع الکتریکی خارجی به عنوان شارژ باتری شناختهمیشود.
در حالی که تبدیل انرژی شیمیایی به انرژی الکتریکی برای تأمین بار خارجی به عنوان تخلیه باتری ثانویه شناختهشدهاست.
در حین شارژ باطری ، جریان از طریق آن عبور میکند که باعث ایجاد برخی تغییرات شیمیایی در داخل باتریمیشود. این تغییرات شیمیایی انرژی را در هنگام شکل گیری آنها جذبمیکند.
هنگامی که باطری به بار خارجی وصلشود ، تغییرات شیمیایی درجهت معکوس اتفاق میافتد که در طی آن ، انرژی جذب شده به عنوان انرژی الکتریکی آزاد می شود و به بار تامینمیشود.
حال سعی خواهیم کرد که اصل کار باتری سربی اسیدی را درک کنیم و برای اولین بار در مورد باتری سربی اسیدی که معمولاً به عنوان باتری ذخیره سازی یا باتری ثانویه استفادهمیشود ، صحبت خواهیمکرد.
باطری منیزیم / ساختار باطری منیزیم
==-==-==-==-==-==-==-==-==-==-
مواد مورد استفاده برای سلولهای باطری ذخیره سازی سربی اسیدی
مواد اصلی فعال مورد نیاز برای ساخت باتری سربی اسیدی بصورت زیرهستند
- پراکسید سرب (PbO2)
- سرب اسفنجی (سرب)
- اسید سولفوریک رقیق شده (H2SO4)
پراکسید سرب (PbO2)
صفحه مثبت از پراکسید سرب ساخته شدهاست. این ماده قهوه ای تیره ، سخت و شکنندهاست.
سرب اسفنجی (سرب)
صفحه منفی از سرب خالص و به حالت اسفنج نرم ساختهشدهاست.
اسید سولفریک رقیق (H2SO4)
اسید سولفوریک رقیق مورد استفاده برای باتری سربی اسیدی نسبت آب : اسید = 3: 1.(آب 3 برابر)
عملکرد باطری سربی اسیدی با فرو بردن صفحه پراکسید سرب و صفحه سرب اسفنج در اسید سولفوریک رقیق تشکیلمیشود.
یک بار خارجی بین این صفحات وصلمیشود. در اسید سولفوریک رقیق ، مولکولهای اسید به یونهای هیدروژن مثبت H +)) و یونهای سولفات منفی SO4 – -)) تقسیممیشوند.
یونهای هیدروژن وقتی به صفحه PbO2 میرسند ، الکترونهایی از آن دریافت میکنند و به اتم هیدروژن تبدیل میشوند که دوباره به PbO2 حمله میکنند و PbO و H2O ( آب) را تشکیل میدهند.
این PbO با H2 SO4 واکنش نشان می دهد و PbSO4 و H2O (آب) را تشکیل میدهد.
یون هایSO4
– – آزادانه در محلول حرکت میکنند ، بنابراین برخی از آنها به صفحه سرب خالص میرسند ،
جایی که الکترون های اضافی خود را میدهند و SO4 رادیکال میشوند. از آنجا که SO4 رادیکال به تنهایی نمیتواند وجود داشته باشد به سرب حمله میکند و PbSO4 را تشکیلمیدهد.
از آنجا که یونهای H الکترونها را از صفحه PbO2 و یونهای SO4 – الکترونها را به صفحه سرب میدهند ،
نابرابری الکترونها بین این دو صفحه وجوددارد. و از این رو جریان برق از طریق بار خارجی بین این صفحات به منظور تعادل این نابرابری الکترون ها جریان مییابد. به این فرایند تخلیه باتری سربی اسیدی گفتهمیشود.
نگهداری و تست های دوره ای باطری ها( اسیدی – نیکل کادمیوم و …)
==-==-==-==-==-==-==-==-==-==-
سولفات سرب ((PbSO4)) به رنگ سفید است. هنگام تخلیه ،
- هر دو صفحه با PbSO4 پوشانده شدهاست.
- وزن مخصوص محلول اسید سولفوریک به دلیل تشکیل آب در هنگام واکنش در صفحه PbO2 کاهش مییابد.
- در نتیجه ، میزان واکنش کاهش مییابد که نشان دهنده کاهش اختلاف پتانسیل بین صفحات در طی فرآیند تخلیهاست.
اکنون بار را جدا میکنیم و PbSO4 پوشانده شده با صفحه PbO2 را با ترمینال مثبت یک منبع DC خارجی و PbO2 پوشانده شده
ازصفحه Pb با ترمینال منفی آن منبع DC متصل میکنیم. در حین تخلیه ، چگالی اسید سولفوریک کاهش مییابد اما اسید سولفوریک هنوز در محلول وجوددارد.
این اسید سولفوریک همچنین به عنوان یون های H + و SO4− در محلول باقی میماند. یون های هیدروژن (کاتیون) شارژ شده با بار مثبت ، به الکترود (کاتد) که به ترمینال منفی منبع DC متصل شدهاستحرکت میکند.
در اینجا هر یون H یک الکترون از آن گرفته و به اتم هیدروژن تبدیل میشود. این اتمهای هیدروژن سپس به PbSO4 حمله میکنند و سرب و اسید سولفوریک را تشکیلمیدهند.
SO4− – یونها (آنیونها) به سمت الکترود (آند) متصل به ترمینال مثبت منبع DC حرکت میکنند که در آنها الکترون های اضافی خود را رها میکنند و SO4 رادیکالمیشوند.
این SO4 رادیکال به تنهایی نمیتواند وجود داشتهباشد از این رو با PbSO4 از آند واکنش نشان میدهد و پراکسید سرب (PbO2) و اسید سولفوریک (H2SO4) را تشکیلمیدهد.
از این رو با شارژ سلول باطری ذخیره سربی اسیدی ،
- آند سولفات سرب به پراکسید سربتبدیلمیشود.
- سولفات سرب کاتد به سرب خالصتبدیلمیشود.
- در ترمینال؛ پتانسیل سلولافزایشمییابد.
- وزن مخصوص اسید سولفوریکافزایشمییابد.
==-==-==-==-==-==-==-==-==-==-
مقالات مرتبط :
اصول الکترولیز/ الکترولیت سولفات مس
فرآیند یونیزاسیون و تعریف (یونیزاسیون چیست)
لینک زبان اصلی مقاله :
https://www.electrical4u.com/working-of-lead-acid-battery-lead-acid-secondary-storage-battery/