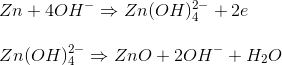مقالات, مقالات باتری و UPS
باتری اکسید جیوه
باتری اکسید جیوه | ساختار شیمیایی و مزایایآنها
درطول جنگ جهانی دوم داشتن ولتاژ ثابت ، ظرفیت زیاد ، سیستم باتری طولانی مدت برای استفاده در شرایط گرمسیری شدید ضروریبود.
فناوری باتری اکسید جیوه روی بیش از 100 سال شناختهشدهبود ، امااولین بار توسط ساموئل روبن در طول جنگ جهانی دوم مورداستفادهقرارگرفت.
بدلیل ویژگیهای ولتاژ ثابت و پایدار ، استفاده ازآن در ساعتها ، دوربینها و سایر وسایل الکترونیکی کوچک بسیارمفیداست. همچنین دربرخی از مدلهای اولیه ضربان سازها از آن استفاده میشد.
بخاطر ویژگی ولتاژ خروجی بسیار پایدار ، از باتری اکسید جیوه به عنوان منبع مرجع ولتاژ در ابزاراندازه گیری الکتریکی استفادهمیشود. علاوه براینها ، از اینباتری درمعادن کوچک پراکنده ماهواره ، مجموعههای رادیویی و ماهوارههای اولیهاستفادهمیشد.
اکنون این باتری به دلیل مشکل محیطی در ارتباط با جیوه منسوخمیشود. بهطور عمده دو نوع باتری اکسید جیوه وجوددارد – یک باتری اکسید روی و دو باتری اکسید جیوه کادمیوم.
مشکلات محیطی با کادمیوم نیز همراهاست. بازار این باتری توسط دی اکسید منگنز قلیایی ، روی-هوا ، اکسید نقره و باتری لیتیوم اشغالشدهاست.
مزایای باتری اکسید جیوه روی
- چگالی انرژی بسیاربالاییدارد. حدود 450 وات/لیتر
- عمر بسیار طولانیدارد.
- درزیرطیف گستردهای ازچگالی جریانپایداراست.
- راندمان الکتروشیمیایی بسیاربالاییدارد.
- بسیارمقاوماست و بطور کلی نسبت بهتأثیر مکانیکی و لرزش حساسنیست.
- ولتاژ مدار باز 1.35 ولت پایدار میدهد که یک مزیت مهم باتری جیوه رویاست.
- این ولتاژ پایدار رادر طول دوره طولانی تخلیه جریانمیدهد.
معایب باتری اکسید مرکوریک روی
- این باتریها بسیارگرانهستند. بههمین دلیلاست کهآنهااستفادهمحدودیدارند.
- اگرچه نسبت انرژی به حجم باتری زیاداست اما نسبت انرژی به وزن متوسطاست.
- عملکرد اینباتری دردمای پایین بسیار مناسبنیست.
- باتوجه به وجود جیوه ، دفع باتری اکسید جیوه روی موردمشکلزااست .
مزایای باتری اکسید جیوه کادمیوم
- ماندگاری بیشتریدارد.
- دارای منحنی تخلیه مسطح تردر طیف وسیعی از جریاناست.
- برخلاف باتریی اکسید روی ، در دمای پایین کارآمداست.
- تکامل گاز باتری اکسید جیوه کادمیوم کماست.
معایب باتری اکسید جیوه کادمیوم
- بدلیل داشتن کادمیوم نسبت به باتری اکسید جیوه روی گران تراست.
- ولتاژ استاندارد مدار باز این باتری 0.9 ولتاست که بسیار پایین تر از باتری اکسید جیوه رویاست.
- نسبت انرژی به حجم آن متوسط و نسبت انرژی به وزن کماست.
- دفع آنهمچنین بدلیل دارا بودن کادمیوم و جیوه مشکل محیطی ایجادمیکند.
ساختار باتری اکسید مرکوریک
این باتری عمدتاً به شکل دکمه ، مسطح و استوانه ای تولیدمیشد. درشکل دکمه ای، قسمت بالای باتری از آلیاژ مس در قسمت داخلی و نیکل یا استیل ضد زنگ در قسمت بیرونی ساختهشدهاست. پوشش بالا ازداخل ظرف با یک نایلون عایق بندیمیشود. پودر روی مخلوط شده در داخل پوشش بالا پراکندهاست. قسمت پایین ظرف با مخلوطی از اکسید جیوه و گرافیت پرمیشود. گرافیت در اینجا به افزایش هدایت اکسید جیوه کمک میکند.
همچنین
اکسید جیوه ماده اصلی کاتد باتریاست. قسمت بالای مخلوط کاتد با هیدروکسید پتاسیم یا سد متخلخل خیسشده از الکترولیت هیدروکسید سدیمپوشاندهشدهاست.اکنون کل پوشش بالا بههمراه آند به داخل ظرف پایین پرس میشود. اکنون قسمت بالای باتری آند و قسمت پایین آن کاتداست و جداکننده متخلخل حاوی الکترولیت موجود در بین آنهااست. کل مونتاژ با بستن لبه بالایی قوطی یا ظرف پایین ، کاملاً محکم در کنار همقرارمیگیرد. در پیکربندی مسطح ، پودر روی با هم مخلوط شده و درون یک ظرف قرص مانند فشردهمیشود. پوشش بالای باتری با روکش پلیمری یکپارچه قالب دو لایهپوشاندهشدهاست. صفحات فوقانی بیرونی و داخلی از فلز اندود نیکل ساختهشدهاست ، اماصفحه داخلی قلع اندود روی سطح داخلیاست. ظرف اصلی سلول نیز از دو قوطی ساخته شده از جنس استیل ساختهشدهاست.
و لوله آداپتور در فضای بین قوطی داخلی و خارجی قرار میگیرد. قسمت زیرین ظرف با مخلوط کاتد پرمیشود و در بالای الکترولیت مخلوط کاتد ، جاذب ها قرار میگیرند. مونتاژ گرانوم بالا به همراه پالت آند به داخل قوطی داخلی فشرده می شود و سیلد با خم کردن روی قوطی بیرونی انجام میشود. سوراخ دریچه ای در قسمت خارجی محفظه ایجاد شده است به گونه ای که گازهای تولید شده در هنگام تخلیه را به راحتی بین قوطی های داخلی و خارجی فرار خارج شود ، هرگونه الکترولیت موجود در لوله توسط آداپتور کاغذ جذبمیشود.
شیمی باتری اکسید جیوه
از دو نوع الکترولیت قلیایی در سلول روی / جیوه استفاده میشود ، یکی هیدروکسید پتاسیم و دیگری هیدروکسید سدیم. الکترولیت سدیم هیدروکسید سدیم به طور کلی در مواردی مورداستفادهقرارمیگیرد که عملکرد دمای پایین و تخلیه جریان زیاد ضرورینباشد. این الکترولیت به طور کلی در سلول اکسید روی جیوه استفادهمیشود ، درحالی که الکترولیت مبتنی بر هیدروکسید پتاسیم فقط در سلول اکسید جیوه کادمیوماستفادهمیشود. کادمیوم درمحلول هیدروکسید پتاسیم نامحلولاست و به همین دلیل سلول اکسید جیوه کادمیوم برای عملکرددمای پایین کاملاً مناسباست.
واکنش آند در باتری اکسید روی
واکنش آند رامی توان بصورت زیرنوشت:
این واکنش میتواند ساده شود ،
واکنش آنددر باتری اکسید جیوه کادمیوم
واکنش آندرا میتوان به صورت زیرنوشت:
ازاین رو این واکنش آب ایجادنمیکند. الکترولیت مورد استفاده دراین سلول باید درصد بالاییاز آب داشتهباشد.
واکنش کاتدی در باتری اکسید مرکوریک
واکنش کاتد باتری رامیتوان بصورت زیرنوشت:
ولتاژ باتری اکسید مرکوریک
ولتاز مدار باز یا بدون بار باتری اکسید جیوه روی 1.35 ولتاست. ولتاژ بار باتری جیوه روی در مدت چند سال در حدود 1٪ باقیمیماند. این ولتاژ بدون بار ممکناست به ترتیب 2.5 میلی ولت متفاوتباشد اگردمای کار باتری از – 20 درجه سانتیگراد تا + 50 درجه سانتیگراد متفاوتباشد. اینباتری دارای ویژگی تخلیهمسطحاست ،به این معنی که ولتاژ باتری برای طولانی ترشدن مدت تخلیه با جریانهای مختلف تقریباًیکساناست. ولتاژ مدار باز باتری اکسید جیوه کادمیوم 0.9 ولتاست و درکلیه شرایط عملیاتی در محدوده دما از – 55oC تا + + 80oC کاملاً پایداراست. اگرچه دمای تا به + 180 درجهسانتیگراد با طراحی ویژه باتریحاصلشدهاست.
ذخیره باتری اکسید مرکوریک
ویژگی ذخیره سازیاینباتریکاملاً مناسباست و عمرآن درجدول زیرآوردهشدهاست.
مقالات مرتبط :
ویژگی ها و عملکرد باتری آهن نیکل یا باتری ادیسون
باتری کربن روی/ انواع باتری کربن روی/ مزایا و معایب
عملکرد باتری سربی اسیدی ثانویه | باتری ذخیره سازی سربی اسیدی ثانویه